Știri
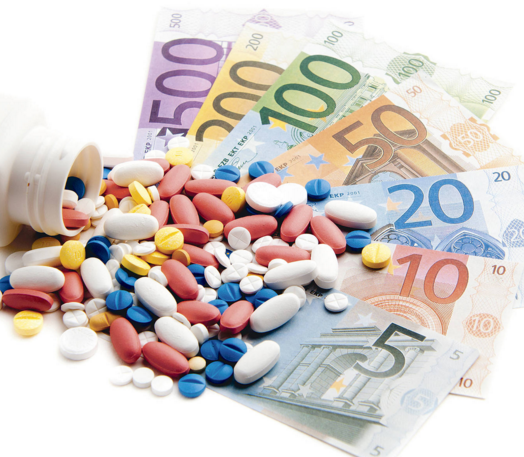
Процедура регистрации лекарственных средств на отечественном рынке упрощена
via | www.ipn.md
„Acest articol aparține exclusiv P.P. „Monitorul fiscal FISC.md” și este protejat de Legea privind drepturile de autor.
Orice preluare a conținutului se face doar cu indicarea SURSEI și cu LINK ACTIV către pagina articolului”.
Autentificare
Autentificarea se poate efectua cu ajutorul adresei de E-mail sau a Login-ului
E-mail/Login *
Parola *
Contul de utilizator a fost creat cu succes. Pentru confirmarea înregistrării accesați linkul expediat la e-mailul indicat în formularul de înregistrare, care este valabil până la 30 zile calendaristice
Adresează-ne o întrebare
Dorești să obții un răspuns rapid si complex sau să ne sugerezi tematica unui articol necesar procesului tău de lucru? Loghează-te, expediază întrebarea sau sugestia și primești răspunsul experților în cel mai scurt timp la adresa de e-mail sau în profilul tău de pe pagină.
E-mail *
Comanda serviciului prin telefon
Introduceți corect datele solicitate și în scurt timp veți fi contactat de un operator
Prenumele *
Numele *
E-mail *
Telefon *
Feedback
Pentru monitorizarea statutului de prelucrare a Feedbackului expediat, recomandăm inițial să parcurgeți procesul de autentificare pe portal. Astfel, mesajul de răspuns din partea PP „Monitorul Fiscal FISC.md” la feedback se va salva și afișa în Profilul Dvs. În cazul expedierii feedback-ului fără a fi autentificat pe portal, mesajul va fi remis la adresa de e-mail.
E-mail *
E-mail *

1877 vizualizări
Data publicării:
14 Aprilie /2016 11:00
Catalogul tematic
Noutăți
Etichete:
лекарства | доступные | документация | сертификаты | улучшить обеспечение | рынок медикаментов
0 comentarii
Doar utilizatorii înregistraţi şi autorizați au dreptul de a posta comentarii.